Von Dr. Sebastian Bertram, Leitender Sicherheitsbewerter, Wessling, Winfried Rämisch, Sachverständiger Kosmetik, Wessling, Antonia Mainka und Anja Fischer, Leitende Sachverständige Kosmetik, Wessling

Einleitung
Umweltpolitische Themen wie Klimawandel, CO2-Neutralität, Nachhaltigkeit, Umweltschutz, Abfallvermeidung und Recycling sind in den letzten Jahren zunehmend in den Mittelpunkt des öffentlichen Interesses und der Politik geraten. Sie werden als wichtiger Bestandteil des Green Deals durch die EU berücksichtigt. Vermeidungsstrategien, alternative Rohstoffe, nachhaltige Rohstoffgewinnung oder auch Recycling sollen die Energie- und CO2-Bilanz sowie den Ressourceneinsatz in Zukunft deutlich verringern.
Besonders das Thema Packmittel für Kosmetische Mittel und deren Qualität, sowie die Anforderungen an eine sichere Verwendung, sind in den letzten Jahren mit dem Umweltbewusstsein des Verbrauchers und im umweltpolitischen Kontext besonders für sogenannte PCR- und PIR-Packmittel (post consumer recycling- und post industrial recycling-Packmittel) in den Vordergrund gerückt. Somit steigt die Nachfrage nach recycelten Packmittelmaterialien an den Handel, die Kosmetikhersteller und letzten Endes an die Packmittellieferanten.
Für Packmittel von Kosmetischen Mitteln gibt es derzeit wenig konkrete rechtliche Vorgaben. Diese leiten sich oft nur indirekt von anderen Gesetzen ab. Oftmals orientiert man sich daher an den regulatorischen Anforderungen für Lebensmittelpackmittel und der europäischen Kosmetikverordnung1.
Diese europäischen Verordnungen werden durch verschiedene weitere Verordnungen, wie zum Beispiel VO (EG) Nr. 1907/2006 (REACh), Richtlinie 94/62/EG über Verpackungen und Verpackungsabfälle, RoHS-Richtlinie 2011/65/EG (u.a. Grenzwerte für Schwermetalle und Phthalate), Richtlinie 2018/2013/EG (Spezifische Spezifische Migrationswerte und Verbote für Bisphenol A in Lacken und Beschichtungen, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen), und das Lebensmittel-, Bedarfsgegenstände- und Futtermittelgesetzbuch (LFGB) für Deutschland (national), um nur einige zu nennen, auf europäischer und nationaler Ebene, ergänzt2, 3, 4, 5, 6.
Für Druckfarben und Lacke, um diese hier nur am Rande zu erwähnen, gibt es noch keine strikte europäische Gesetzgebung, siehe hierzu auch die 21. Verordnung zur Änderung der Bedarfsgegenständeverordnung als nationale Regelung, AP(89)1-Resolution, BfR-Empfehlung (BfR-Recommendation IX: Colorants for Plastics and other Polymers Used in Commodities), VdL-Richtlinie (Verband der deutschen Lack- und Druckfarbenindustrie (VdL): VdL-RL 01, Schweizer Druckfarbenverordnung7, 8, 9, 10, 11.
Für Packmittel aus Glas, Papier, Holz, Alu etc. gelten ebenfalls die VO (EG) Nr. 1935/2004, VO (EG) Nr. 1223/2009, Richtlinie 94/62/EG, VO (EG) Nr. 1272/2008, das LFGB und der Bedarfsgegenständeverordnung (national)12, 13, 3, 14, 6, 7.
Die in den USA geregelten Prozesse zum Umgang und zur Freigabe von PCR-Materialien unterscheiden sich in ihrer Methodik und Berechnungen15, 16, 17 erheblich vom europäischen System, sodass diese nur bedingt hierauf übertragbar sind. Im Lebensmittelbereich wird der sogenannte No Objection Letter in Europa nicht anerkannt.
Da jedoch PCR-Packmittel aus oftmals unkontrollierten, offenen Kreisläufen hergestellt werden, ist es kaum möglich, die Verunreinigungen, die aus den Kunststoffen stammen können, zu kontrollieren. Auch geschlossene Kreisläufen bergen Probleme. So bleibt es immer noch eine hohe Herausforderung, den Anforderungen der EU zu genügen und die geforderte Sicherheit für das Packmittel zu erfüllen.
Die Dokumentation, besonders für PCR-Materialien, deckt oftmals nicht die regulatorischen Anforderungen im Umfang und den geforderten Parametern ab. Oftmals liegen nur unzureichende Daten zum Granulat vor. Ein besonderes Problem sind unidentifizierte Substanzen, wie man sie meist im NIAS-Screening (nonintentionally added substances) detektiert.
Dokumentation für Packmittel aus Virgin- und Recyclingmaterial und Fallstricke
Für Packmittel sollten geeignete Konformitätserklärungen für die folgenden Verordnungen und Richtlinien vorliegen (ggf. auch oben genannte Resolutionen, Gesetze und Empfehlungen zu den
Farben und Lacken für Packmittel):
- Konformitätserklärung mit Verordnung (EG) Nr. 1935/2004 (über Materialien und Gegenstände, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen) 12
- Konformitätserklärung mit Verordnung (EU) Nr. 10/2011 (über „Materialien und Gegenstände aus Kunststoff – Lebensmitteln“) 18
- Konformitätserklärung mit Verordnung (EG) Nr. 2023/2006 (über „gute Herstellungspraxis für Materialien und Gegenstände – Lebensmitteln“) 19
- Konformitätserklärung mit Verordnung (EU) Nr. 2022/1616, ehemals Verordnung (EU) Nr. 282/2008 (über „Materialien und Gegenstände aus recyceltem Kunststoff – Lebensmitteln“)20
- Konformitätserklärung mit Verordnung (EU) Nr. 1223/2009 (entspricht im wesentlichen Anhang II und den Begrenzungen des Anhang III der Kosmetikverordnung) 13
- Konformitätserklärung mit Verordnung (EU) Nr. 1272/2008 (CLP – Einstufung Sensibilisierer, Artikel 15 – CMR) 14
- Richtlinie 94/62/EG 2
In Europa ist bisher nur für PET (Polyethylenterephthalat) als reines post-consumer Recyclingmaterial ein Verfahren durch die EFSA (European Food Safety Authority) für Lebensmittelverpackungen genehmigt. Für alle weiteren Kunststoffe muss auf alternative Bewertungsverfahren zurückgegriffen werden. Diesen Bewertungen gehen umfangreiche Analysen der Packmittel voraus 21.
Meist steht die Dokumentation nur für das Granulat zur Verfügung, da im Rahmen der Lieferkette und der damit verbundenen Verwendung (Gebindegröße, Verarbeitung) nicht jeder Fall berücksichtigt werden kann. Es gibt normalerweise eine entsprechende Ausschlussklausel, die die Verantwortung für das fertige Packmittel auf den Kunden/Kosmetikhersteller überträgt. Durch die Verarbeitung kann es zu zusätzlichen Kontaminationen aus der Produktion kommen.
Meist wird jedoch nur eine Konformität mit der Verordnung (EU) Nr. 10/2011 im Hinblick auf eine globale Migration deklariert18. Dabei werden die entsprechenden Rahmenparameter meist nicht genannt. SML-Werte (Specific Migration Limit) findet man bisher nur selten. Die Konformitäts-erklärungen sollten sich an die entsprechenden Anhänge halten, hier insbesondere die VO
(EG) Nr. 1935/2004 12, während sich die meisten anderen Konformitätserklärungen auf die gelisteten Substanzen aus den Anhängen der jeweiligen Verordnungen beziehen. Aus der Deklaration sollte mindestens die Identität des Materials, des Herstellers/Lieferanten und das Datum genauso hervorgehen, wie die einzelnen Prüfparameter, wie sie in der EU-Verordnung Nr.10/2011 dargestellt sind, damit sich die entsprechende Eignung erkennen lässt 18.
Methoden und übliche Prüfparameter in der Analytik
Die Methoden und Prüfparameter orientieren sich an der EU-Verordnung Nr. 10/2011. Gewöhnlich wird für Packmittel im Kosmetikbereich mit einem MHD (Mindesthaltbarkeitsdatum) von mehr als 6 Monaten oder einem PAO (Period after opening) für eine Lagerung bei Raumtemperatur ein Migrat bei 60°C für 10 Tage mit unterschiedlichen Simulanzien erstellt. Für nähere Details und Sonderfälle sei auf die Verordnung verwiesen.
Als erste Bedingung zur Ermittlung der ausreichenden Qualität kann mittels Globalmigration (z.B. 40°C, 10 Tage) eine erste vorsichtige Abschätzung erfolgen. Diese reicht jedoch auf keinen Fall
aus, um die Qualität und Sicherheit festzustellen. Durch ein Screening mit 50% oder 95% Alkohol können unspezifische Substanzen detektiert werden (NIAS-Screening bzw. 10 ppb-Screening).
Für identifizierte Substanzen, die 10 ppb nicht überschreiten und als nicht genotoxisch eingestuft werden, kann eine detaillierte toxikologische Bewertung entfallen. Für eine spezifische Migration nutzt man Ethanol (10%- 95%), Essigsäure 3%, Pflanzenöl und TENAX (Absorbent; Poly(2,6-diphenyl-p-phenylenoxid).
Materialprüfungen (ohne Lagerung, direkte Extraktion) werden durchgeführt, wenn keine Daten zu SVHCs vorliegen. Es werden zusätzliche Untersuchungen zu PAKs, Nonylphenolen, Phthalaten, Chlorparaffinen, Schwermetallen etc. empfohlen.
Nicht-polare Substanzen lösen sich in nicht-polaren Kunststoffen (PE, PP) und Füllgütern (Fett, Öl, O/W-Emulsionen). Somit lassen sich spezifische PAKs (Polyzyklische aromatische Kohlenwasserstoffe) und Phthalate im Migrat (Pflanzenöl) analysieren.
Polare Substanzen lösen sich in polaren Kunststoffen (PET), wässrigen polaren und nicht-polaren Füllgütern (O/W-Emulsion (Milch), tensidhaltige, alkoholhaltige oder wässrige Lösungen). Somit können polare als auch nicht-polare Substanzen wie Bisphenol A im Migrat analysiert werden.
Schwermetalle, Primäre aromatische Amine (PAA) und Formaldehyd werden in einem Essigsäuremigrat analysiert und simulieren damit Lösungen mit niedrigem pH-Wert.
Für Puder kann alternativ zu den oben genannten Simulanzien auch TENAX als Simulanz verwendet werden.
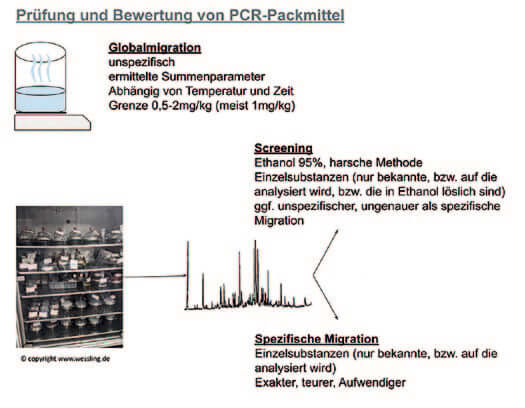
Abbildung 1: Gegenüberstellung von Prüfmethoden und ihrem Fokus
Bewertung von kosmetischen Packmitteln, die nicht dem Lebensmittelstandard entsprechen – Riskiobasierter Ansatz, NIAS, unidentifizierte Substanzen
Die Bewertungsgrundlagen unterscheiden sich zwischen dem Lebensmittel- und Kosmetikrecht.
Die Bewertung für Kontaminationen aus Lebensmittelkontaktmaterialien wird durch entsprechende Verordnungen geregelt. Dazu werden Grenzwerte (z. B. SML, SML(T), OML)18 aus verschiedenen Verordnungen berücksichtigt und für die Berechnungen wird das TTC-Konzept (Threshold of Toxicological Concern) angewandt. Die Berechnungsgrundlage basiert jedoch auf der oralen Aufnahme von 1 kg Lebensmittel. Dies ist also eine relativ standardisierte Herangehensweise. Dagegen verhält es sich bei der Kosmetik individueller.
Hier wird der Ansatz einer anwendungsbezogenen und risikobasierten Betrachtung, die das gesamte Expositionsszenario berücksichtigt, verfolgt. Dabei werden spezifische Parameter wie rinse-off oder leave-on, Anwendungsmenge und -häufigkeit sowie individuelle Absorptionsraten für INCI und Substanzen berücksichtigt. In die Bewertung gehen weniger Grenzwerte und vielmehr PoD-Werte (Point of Departure, „toxikologische Endpunkte“), wie z. B. der NOAEL (No Adverse Effect Level, aus subchronischer Anwendung, 90 Tage) oder das TTC-Konzept22, 23, 24 ein.
Die im Anhang II der Kosmetikverordnung gelisteten Substanzen dürfen als technisch unvermeidbare und toxikologisch vertretbare Spuren als Verunreinigung im kosmetischen Mittel nachgewiesen werden.
Als worst-case-Betrachtung sei hier auf die beiden Produkttypen Sunscreen als leave-on-Produkt und das Shower gel als rinse-off-Produkt verwiesen; Sonnenmilch: 18 g/d, leave-on (Rt = 1), Systemische Expositionsdosis (SED) 300 mg x kg bw-1 x d-1 für Erwachsene
Duschgel: 18 g/d, rinse-off (Rt = 0,01), SED 2,79 mg x kg bw-1 x d-1 für Erwachsene
Für weitere Details sei verwiesen auf das Cosmetic Packaging Guidance Document – How to evaluate post-consumer polyolefin recyclates in cosmetic packaging, February 202125.
Ein Beispiel – Phthalat
Ein Packmittel für eine Bodylotion wird geprüft, Zielgruppe Erwachsene. Daraus ergibt sich lt. „SCCS NOTES OF GUIDANCE 12TH REVISION“ (SCCS/1647/22)22 eine tägliche Gesamtexposition von 123,2 mg x kg bw-1 x d-1.
Dibutylphthalat (DBP, CAS Nr. 84-74-2) ist in Anhang II, Position 675 der Verordnung (EG) Nr. 1223/2009 gelistet und daher verboten. Es gibt eine Reihe von Gründen, warum man nun eine spezifische Migration veranlassen kann. Z. B. können Unterlagen zu dem Packmittel gänzlich oder teilweise fehlen, gegebenenfalls sogar unglaubwürdig wirken. Es kann aus den Unterlagen in Form einer Konformitätserklärung hervorgehen, dass DBP enthalten ist, oder während einer Materialprüfung oder im NIAS-Screening nachgewiesen wird. Nun ist es wichtig, die mögliche Migration ins Füllgut zu simulieren. Obwohl der Grenzwert für DBP in der Verordnung (EG) Nr. 10/2011 von 0,3 mg/ kg18 festgelegt wurde, ist DBP lt. Annex II/67513 und durch die Einstufung als CMR-Stoff (reprotox 1B, 2)14 gemäß Artikel 15 der europäischen Kosmetikverordnung in kosmetischen Mitteln gänzlich verboten, bzw. gemäß Artikel 17 nur in Spuren als technisch unvermeidbare Verunreinigung erlaubt, wenn diese toxikologisch vertretbar ist13.
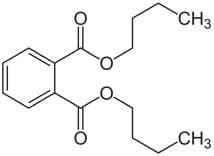
Abbildung 2: Struktur Dibutylphthalat
(Quelle:https://upload.wikimedia.org/wikipedia/commons/thumb/b/b4/Dibutylphthalate_Structural_Formulae_V.1.svg/1280px-Dibutylphthalate_Structural_Formulae_V.1.svg.png)
Prüfplan/Prüfung
Erstellung eines Migrates mit Öl (als worst-case, maximale Löslichkeit des Phthalates in Öl) oder Ethanol 10% oder 50%, angepasst an das kosmetische Mittel. Prüfbedingungen sollten sein:
10 Tage bei 60°C, um einer Lagerung bei Raumtemperatur von mehr als 30 Monaten gerecht zu werden.

Abbildung 3: Vorbereitung eines
Migrationstests
Auswertung
Abhängig von der Matrix des kosmetischen Mittels kann DBP unterschiedlich in das Füllgut migrieren. Nun muss geprüft werden, ob die Anwendung für das kosmetische Mittel toxikologisch vertretbar ist. In der Risikobetrachtung wird unter toxikologischen Aspekten die Anwendung (leave-on, rinse-off, Baby, Erwachsener, etc.) und Anwendungsmenge berücksichtigt.
Beispielrechnung: Die relative tägliche Exposition des Produktes wird mit der Konzentration der Verunreinigung und der dermalen Absorption der Verunreinigung (oder 50% lt SCCS, wenn keine Daten vorliegen) verrechnet. Gefunden wurden 3ppm DBP in einer Verpackung für eine Bodylotion.
SEDDBP = 123,2 mg x kg bw-1 x d-1 x 3ppm x 0,6 = 0,0002 mg x kg bw-1 x d-1. Als PoDsys-Wert wurde eine NOAEL-Wert von 152mg x kg bw-1 x d-1 (als absoluter worst-case; Study report, GLP-Studie. OECD Guideline 408 (Repeated Dose 90-Day Oral Toxicity Study in Rodents/ EPA-TSCA Test Guideline „Functional Observational Battery“, Fed. Reg. Vol. 50, No. 188, Sept. 27, 1985, pp. 39458 – 39461. 90’Tage, orale Aufnahme). Der PoD wird von der oralen auf die dermale Route umgerechnet, dabei wird in der Regel eine Bioverfügbarkeit von 50% angenommen22, also PoDderm = 152mg x kg bw-1 x d-1 /2 = 76mg x kg bw-1 x d-1. Aus dem umgerechneten NOAEL und der SED kann der Margin of safety berechnet werden, der in der Regel mindest 100 sein sollte; MoS = PoDsys/ SEDsys = 76mg x kg bw-1 x d-1/ 0,0002mg x kg bw-1 x d-1 = 380000. Somit wäre die Verunreinigung toxikologisch vertretbar.
NIAS-Screening und nicht-identifizierte Substanzen
Im NIAS-Screening (non-intentionally added substances) gilt der 10 ppb-Grenzwert für nicht gelistete Substanzen hinter einer funktionellen Barriere24 und ein Schwellenwert von > 1000 Da. Ab diesem Wert wird davon ausgegangen, dass die Substanzen kein weiteres Risiko aufgrund ihrer Größe darstellen und nicht systemisch verfügbar sind18.
Aus Artikel 11 der VO (EU) Nr. 10/2011 gilt ein Migrationsgrenzwert von 60 ppm für Substanzen aus dem Anhang I ohne SML oder andere Restriktionen18.
Für nicht-identifizierte Substanzen, die zumeist aus dem NIAS-Screening stammen, ergibt sich eine besondere Problematik, die die Freigabe als PCR-Packmittel für kosmetische Produkte erschwert. Aus dem NIAS-Screening können Substanzen hervorgehen, die unter Zuhilfenahme von Datenbanken nicht identifiziert werden können. Die Gehalte dieser Substanzen liegen in der Regel im unteren ppm-Bereich oder niedriger. Geht man nun davon aus, dass diese Substanzen potentiell mutagen sind, müssen diese mit dem TTCgenotox bewertet werden. Eine Freigabe von großflächig angewendeten leave-on-Produkten (Sunscreens, Bodylotions) kann unter Berücksichtigung des TTCgenotox in manchen Fällen nicht erfolgen, da dieser Wert überschritten wird. Ein Bio-Assay, wie z. B. ein AMES-Test (OECD 471)23, bietet die Möglichkeit auf Mutagenität zu testen. Doch selbst, wenn es zu einem positiven Signal kommt, ist dadurch nicht gewährleistet, dass dieses nicht falsch-positiv ist, in eukaryotischen Zellen reproduzierbar ist oder die Substanz überhaupt während der Anwendung an ihren „Wirkort“ (route-based und tatsächliche dermale Absorptionswerte) in ausreichender Menge gelangt. Es kann also nicht davon ausgegangen werden, dass das Ergebnis repräsentativ und anwendungsorientiert ist, sondern nur Hinweise geben kann. Nach dem allgemeingültigen Vorgehen müsste ein Ames-Test durch eine weitere in-vitro-Studie bestätigt werden.
Quellenverweis
- Bertram S. et al. (2022). Regulatorische Anforderungen an Packmittel von kosmetischen Mitteln mit Schwerpunkt auf Einsatz von PCR-Materialien. Euro Cosmetics October 2022, VOLUME NO. 30 ■ B 50962
- Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates vom 18. Dezember 2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH), zur Schaffung einer Europäischen Chemikalienagentur, zur Änderung der Richtlinie 1999/45/EG und zur Aufhebung der Verordnung (EWG) Nr. 793/93 des Rates, der Verordnung (EG) Nr. 1488/94 der Kommission, der Richtlinie 76/769/EWG des Rates sowie der Richtlinien 91/155/EWG, 93/67/EWG, 93/105/EG und 2000/21/EG der Kommission (Text von Bedeutung für den EWR)
- Richtlinie 94/62/EG des Europäischen Parlaments und des Rates vom 20. Dezember 1994 über Verpackungen und Verpackungsabfälle
- Richtlinie 2011/65/EU des Europäischen Parlaments und des Rates vom 8. Juni 2011 zur Beschränkung der Verwendung bestimmter gefährlicher Stoffe in Elektro- und Elektronikgeräten (Neufassung) Text von Bedeutung für den EWR
- Commission Delegated Regulation (EU) 2018/65 of 29 September 2017 supplementing Regulation (EU) 2016/1011 of the European Parliament and of the Council specifying technical elements of the definitions laid down in paragraph 1 of Article 3 of the Regulation
- Lebensmittel-, Bedarfsgegenstände- und Futtermittelgesetzbuch (Lebensmittel- und Futtermittelgesetzbuch – LFGB)
- Bedarfsgegenständeverordnung BedGgstV Ausfertigungsdatum: 10.04.1992
- COUNCIL OF EUROPE COMMITTEE OF MINISTERS (PARTIAL AGREEMENT IN THE SOCIAL AND PUBLIC HEALTH FIELD) RESOLUTION AP (89) 1 ON THE USE OF COLOURANTS IN PLASTIC MATERIALS COMING INTO CONTACT WITH FOOD
- BfR-Empfehlung (BfR-Recommendation IX: Colorants for Plastics and other Polymers Used in Commodities)
- VdL-Richtlinie (Verband der deutschen Lack- und Druckfarbenindustrie (VdL): VdL-RL 01: Richtlinie zur Deklaration von Lacken, Farben, Lasuren, Putzen, Spachtelmassen, Grundbeschichtungsstoffen und verwandten Produkten
- Verordnung des EDI über Materialien und Gegenstände, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen (Bedarfsgegenständeverordnung) vom 16. Dezember 2016 (Stand am 15. Oktober 2022)
- REGULATION (EC) No 1935/2004 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 27 October 2004
- REGULATION (EC) No 1223/2009 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 30 November 2009 on cosmetic products
- Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006 (Text von Bedeutung für den EWR)
- https://www.fda.gov/food/food-ingredients-packaging/packaging-food-contact-substances-fcs
- https://www.fda.gov/media/150792/download
- https://www.fda.gov/regulatory-information/search-fda-guidance-documents/guidance-industry-preparation-premarket-submissions-food-contact-substances-chemistry
- COMMISSION REGULATION (EU) No 10/2011 of 14 January 2011 on plastic materials and articles intended to come into contact with food
- Verordnung (EG) Nr. 2023/2006 der Kommission vom 22. Dezember 2006 über gute Herstellungspraxis für Materialien und Gegenstände, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen (Text von Bedeutung für den EWR)
- Berichtigung der Verordnung (EU) 2022/1616 der Kommission vom 15. September 2022 über Materialien und Gegenstände aus recyceltem Kunststoff, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen, und zur Aufhebung der Verordnung (EG) Nr. 282/2008 (Amtsblatt der Europäischen Union L 243 vom 20. September 2022)
- Anadón A et al. Food contact materials, Plastics, Poly(ethylene terephthalate), PET, Recycling process, Evaluation, Safety. EFSA Journal 2011;9(7):2184. doi:10.2903/j.efsa.2011.2184
- THE SCCS NOTES OF GUIDANCE FOR THE TESTING OF COSMETIC INGREDIENTS AND THEIR SAFETY EVALUATION 12TH REVISION (SCCS/1647/22)
- Guidance on the use of the Threshold of Toxicological Concern approach in food safety assessment. EFSA Journal 2019;17(6):5708. 10.2903/j.efsa.2019.5708
- ILSI Europe Report Series – GUIDANCE ON BEST PRACTICES ON THE RISK ASSESSMENT OF NON INTENTIONALLY ADDED SUBSTANCES (NIAS) IN FOOD CONTACT MATERIALS AND ARTICLES (Version January 2016)
- Cosmetic Packaging Guidance Document – How to evaluate post-consumer polyolefin recyclates in cosmetic packaging, February 2021 (Pereda et al.; Kooperation von Beiersdorf AG, Werner & Mertz GmbH, Fraunhofer Institute for Process Engineering and Packaging (IVV))



